🕐 ESTA REPORTAGEM FOI PUBLICADA EM Dezembro de 2019. INFORMAÇÕES CONTIDAS NESTE TEXTO PODEM ESTAR DESATUALIZADAS OU TEREM MUDADO.
Desenhamos fatos sobre o uso medicinal do canabidiol
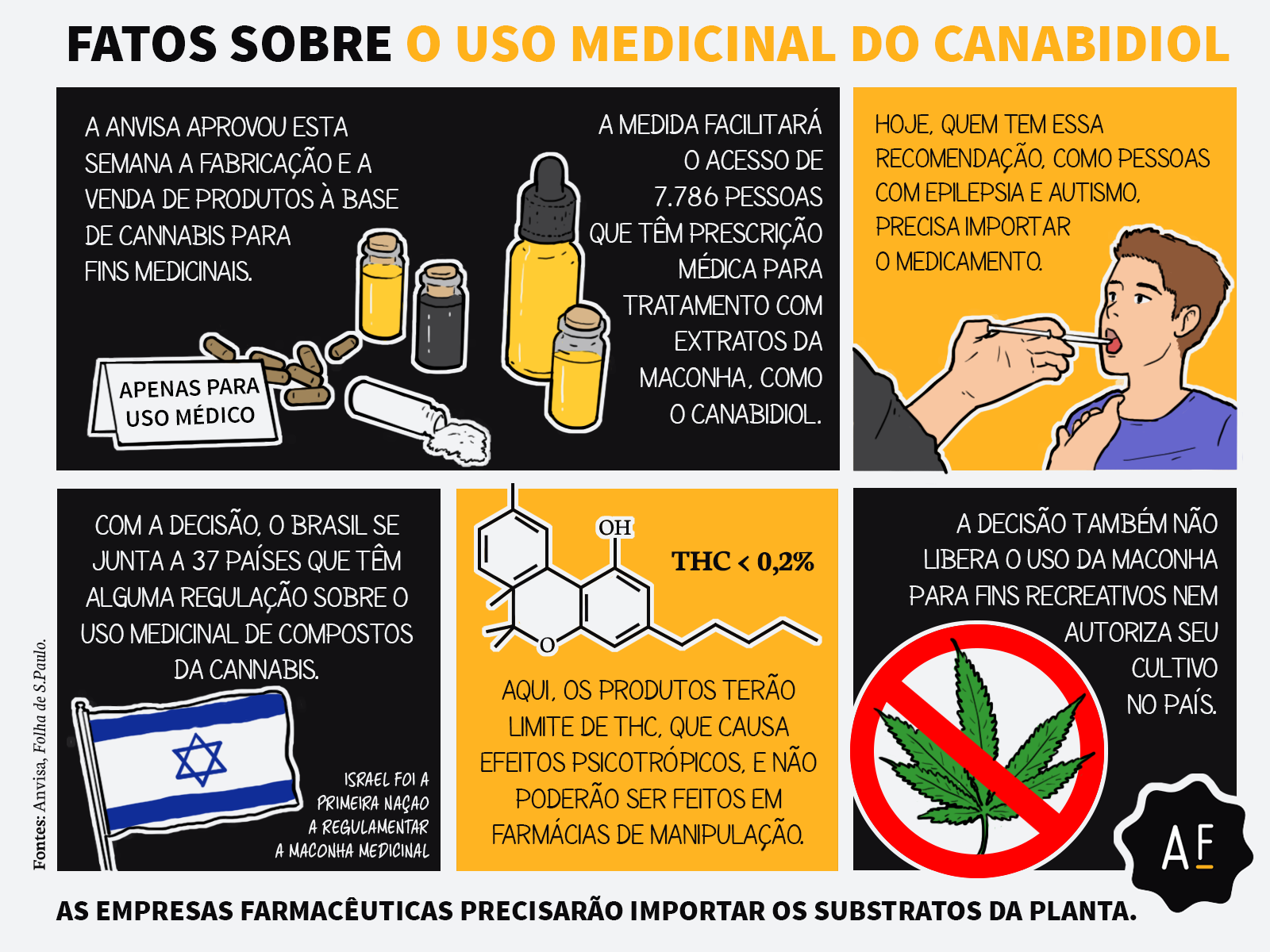
A Anvisa (Agência Nacional de Vigilância Sanitária) aprovou por unanimidade na última terça-feira (3) o registro de produtos derivados de Cannabis para uso medicinal. Com isso, as substâncias, que antes tinham que ser importadas, podem ser produzidas e vendidas pela indústria farmacêutica no Brasil.
A norma entra em vigor em até 90 dias e deve beneficiar mais de 7.000 pessoas que hoje têm prescrição médica para uso desses produtos no tratamento, por exemplo, de epilepsia e dor crônica.
A decisão, que deve ser revista em três anos, só permite que os produtos com substrato da erva sejam consumidos caso haja prescrição médica, não libera o uso recreativo da maconha nem o seu plantio — a Anvisa chegou a debater a regulamentação para isso, mas a proposta foi arquivada por três votos a um.
Mas, afinal, quais são as regras definidas para a fabricação e a venda de produtos à base de Cannabis no Brasil? Quais os impactos da nova regulamentação? Aos Fatos explica na HQ da semana:
A decisão. Após duas consultas públicas, debates na Câmara e no Senado e uma audiência pública, a diretoria da Anvisa aprovou, por unanimidade, um regulamento para produtos à base de Cannabis para uso medicinal. Em resumo, a decisão autoriza a fabricação e a venda desses produtos para pessoas com prescrição médica.
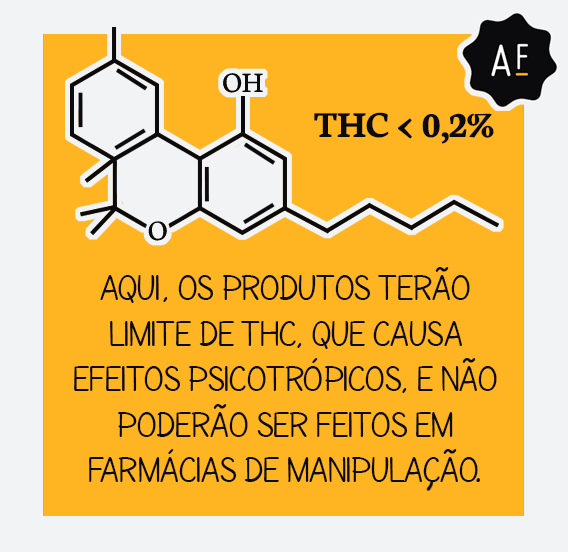
Foram estabelecidas, no entanto, diversas regras para o comércio: as embalagens, por exemplo, deverão conter tarja preta e não poderão citar termos como “medicamentos”, “natural” ou “suplemento”, nem símbolos ou figuras que possam atribuir finalidades diferentes daquelas que possuem. Os produtos também não poderão ser fabricados nem comercializados em farmácias de manipulação.
A nova regulamentação vem cerca de quatro anos após a publicação da Resolução da Diretoria Colegiada 17/2015 da Anvisa, que permitiu a importação de produtos à base de Cannabis em caráter excepcional. Antes do novo regulamento, essa era a única maneira de se conseguir o produto.
De 2015 ao terceiro trimestre de 2019, segundo dados da Anvisa enviados ao Aos Fatos, foram feitas 12.918 solicitações de importação de canabidiol — um dos substratos da maconha. Atualmente, 7.786 pessoas estão cadastradas para adquirir o produto.
O canabidiol é usado no Brasil para tratar principalmente casos de epilepsia, mas também é receitado para pessoas com autismo, dor crônica, Mal de Parkinson e transtornos de ansiedade. Segundo a OMS (Organização Mundial de Saúde), há evidências científicas de que produtos à base de Cannabis podem aliviar náuseas e vômitos em estágios avançados de câncer ou Aids.
Outros países. Com a regulamentação, o Brasil se junta a outros 37 países que permitem o uso medicinal da Cannabis de alguma maneira, conforme mostra levantamento da Folha de S.Paulo. Nos Estados Unidos, por exemplo, ao menos 33 estados permitem o consumo da maconha para fins médicos.
O primeiro estado americano a permitir o uso medicinal dos canabidioides foi a Califórnia, que, em 1996, aprovou um texto que removia as penas criminais de uso, posse e cultivo da erva por pacientes que tivessem prescrição médica.
Mas o primeiro país a legalizar a maconha medicinal foi Israel em 1993, que permitiu o uso por pessoas com câncer, Mal de Parkinson e doença de Crohn. Atualmente, segundo informações do governo israelense, o mercado da Cannabis para fins médicos já atende mais de 50 mil pacientes no país.
Como fica no Brasil? A decisão da Anvisa apenas trata do consumo de produtos à base da Cannabis. A necessidade de prescrição médica ainda permanece: só será possível adquirir esses compostos com receita médica e com a assinatura de um termo de consentimento que detalha o produto à base de Cannabis ao paciente.
Segundo o EMCDDA (Centro Europeu de Monitoramento de Drogas e Drogadição), a Cannabis sativa possui mais de cem componentes conhecidos como canabidióides. Conforme explicado por Aos Fatos anteriormente, pelo menos dois desses componentes químicos têm propriedades medicinais: o CBD (canabidiol) e o THC (tetra-hidrocanabidiol).
A Anvisa prevê a permissão de prescrições de produtos com concentração de THC, composto psicotrópico, menor do que 0,2%, nível em que ele não causa dependência. Concentrações maiores do que 0,2% de THC só serão liberadas para pacientes em fase terminal ou que tenham esgotadas as alternativas terapêuticas de tratamento.
A decisão, portanto, não trata do plantio nem do consumo recreativo da planta. Nem mesmo as empresas farmacêuticas no Brasil que decidirem entrar nesse mercado terão permissão para o cultivo da maconha. Elas deverão importar matéria-prima semielaborada, ou seja, não podem comprar a planta ou parte dela. O plantio da maconha chegou a ser discutido pelos diretores da Anvisa, mas a proposta foi arquivada após decisão contrária da maioria.
Pelo menos 18 países ocidentais já aprovaram leis para o plantio de maconha com fins medicinais. De acordo com o levantamento publicado em 2017 pelo EMCDDA: Alemanha, Austrália, Canadá, Chile, Colômbia, Holanda, Israel, Jamaica, Reino Unido, República Tcheca, Uruguai e alguns estados dos Estados Unidos. Após o estudo, pelo menos outros seis mais seis países também legarizaram o plantio de alguma maneira: África do Sul, Grécia, Lesoto, Peru, Portugal, Suíça e Tailândia.
Referências:
1. Anvisa (Fontes 1, 2, 3
2. OMS
3. Folha de S.Paulo
4. ProCon.org (Fontes 1 e 2)
5. Reuters (Fontes 1, 2 e 3)
6. Invest in Israel
7. EMCDDA (Fontes 1 e 2)
8. Aos Fatos
9. Business Tech
10. BBC
11. EBC
12. Exame
13. Ch.ch